News

- Blog Post
What Added Value Does Real-Time Data Logging Deliver? The Modern Validation Standard
In many pharmaceutical and biotech facilities, validation teams still rely on conventional data loggers paired with reader stations. The logic is familiar. If a system has worked reliably for years, it feels sufficient. However, this assumption often conceals inefficiencies that only surface when teams compare legacy workflows with modern, real-time validation systems.

- Blog Post
IQ, OQ, PQ: cosa significa ciascuna fase nella convalida delle apparecchiature farmaceutiche e biotecnologiche
I produttori farmaceutici e biotecnologici dipendono da apparecchiature precise, affidabili e completamente qualificate per proteggere l'integrità dei prodotti, la sicurezza dei pazienti e la conformità normativa. IQ, OQ e PQ offrono un percorso strutturato per dimostrare che i sistemi funzionano esattamente come previsto. IQ, OQ e PQ rappresentano le tre fasi fondamentali della qualificazione delle apparecchiature, progettate per verificare l'accuratezza dell'installazione, la coerenza operativa e l'affidabilità delle prestazioni. Ogni fase si basa su quella precedente, formando un quadro strutturato che supporta la qualificazione dei processi e la conformità a lungo termine. Insieme, creano una traccia di garanzia documentata che dimostra che le apparecchiature sono idonee all'uso durante tutto il loro ciclo di vita.

- Blog Post
Calibratore a blocco secco vs. bagno di calibrazione della temperatura: una guida pratica alla scelta
Nella convalida farmaceutica e biotecnologica, una calibrazione precisa della temperatura è fondamentale per garantire la qualità. Ogni attività che dipende da misurazioni termiche accurate, dai cicli di sterilizzazione agli studi di stabilità, richiede apparecchiature di calibrazione che garantiscano tracciabilità e prestazioni affidabili. Due riferimenti comunemente utilizzati sono i calibratori a blocco secco e i bagni di temperatura a liquido. Entrambi verificano la precisione dei sensori, ma funzionano in modo diverso e si adattano a casi d'uso diversi. Questo confronto spiega come funziona ciascun metodo e dove offre le migliori prestazioni in ambienti regolamentati, con una selezione basata sulla geometria della sonda, l'incertezza richiesta, la produttività e se la calibrazione viene eseguita in laboratorio o in loco.

- Blog Post
Perché l'industria farmaceutica e biotecnologica dovrebbe affidarsi a software e hardware di convalida termica basati sulla gestione di database.
Nell'industria farmaceutica e biotecnologica, mantenere l'integrità dei prodotti è fondamentale. La convalida termica garantisce che i prodotti sensibili alla temperatura, come vaccini, prodotti biologici e farmaci sterili, siano conservati, trattati e trasportati in condizioni convalidate. I moderni software e hardware di convalida termica, abbinati a robusti sistemi di gestione dei database, forniscono alle aziende soluzioni scalabili, conformi e a prova di futuro che superano i metodi tradizionali.

- Blog Post
Temperature Calibration in Pharma: Why It Matters and How to Do It Right
In pharmaceutical manufacturing, precision is the foundation of safety, efficacy, and regulatory compliance. Each measurement - whether related to temperature, humidity, or pressure - directly impacts product quality and ultimately patient health. Calibration ensures that instruments perform within defined tolerances, aligning results with recognized calibration references. Without regular calibration, measurement drift can compromise data integrity, trigger compliance violations, and endanger product reliability.

- Blog Post
Environmental Monitoring Systems for Pharma, Biotech, and Regulated Industries
Environmental monitoring plays a vital role in ensuring compliance, product integrity, and public safety across regulated industries. Whether in pharmaceuticals, biotech, healthcare, cold storage, or cleanroom facilities, effective monitoring helps organizations maintain validated environments, prevent contamination, and meet global compliance standards.

- Blog Post
Thermal Validation: Ensuring Sterility in Healthcare Pharmaceutical and Food Manufacturing
The assurance of sterility is fundamental in healthcare, pharmaceutical manufacturing, and food processing. Contamination of the products are not only a threat to patient safety and public health but also a significant source of economic liability due to product recalls and regulatory sanctions. Within this context, thermal validation plays a critical role in confirming that sterilization processes are consistent, effective, and compliant with international standards.

- Blog Post
Warehouse Mapping: Ensuring Temperature Integrity Across Critical Environments During Winter
As winter approaches, temperature-controlled environments across industries, from pharmaceuticals and biotechnology to laboratories, logistics, and food storage, face significant challenges. Cold temperatures, fluctuating humidity levels, and uneven heating can jeopardize product stability and regulatory compliance. To address these seasonal risks, organizations rely on warehouse mapping during winter, a precise validation process designed to confirm that environmental conditions remain consistent and compliant throughout the colder months.

- Blog Post
ISO/IEC 17025:2017 – The Global Standard for Calibration Laboratories
ISO/IEC 17025:2017 is the international standard that defines the competence, impartiality, and consistent operation of testing and calibration laboratories. In today’s business and regulatory landscape, accurate, traceable calibration services to meet compliance requirements. Achieving ISO 17025 calibration ensures that laboratories demonstrate both technical proficiency and global credibility. For organizations evaluating calibration labs, this standard is essential in ensuring reliability, regulatory alignment, and long-term trust. The adoption of ISO 17025 is not simply a compliance exercise but a strategic investment in quality and operational excellence.
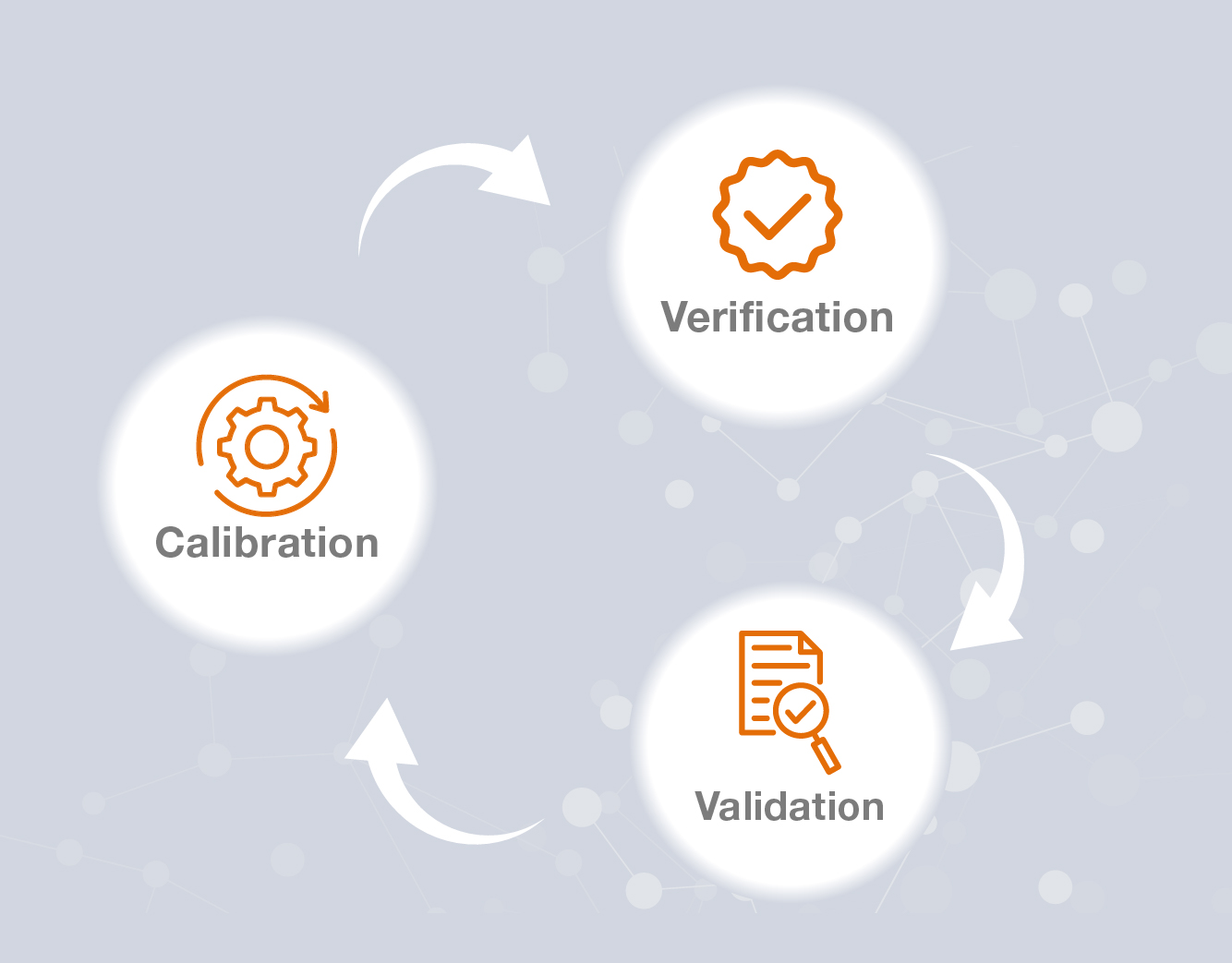
- Blog Post
Calibration, Verification, and Validation Explained: Achieving Accuracy and Regulatory Compliance
In precision-driven industries such as pharmaceuticals, biotechnology, and life sciences, calibration, verification, and validation form the foundation of effective quality assurance. While often misunderstood or used interchangeably, each process serves a distinct role in ensuring measurement accuracy, operational reliability, and regulatory compliance. Understanding how they differ—and work together—is essential for maintaining consistency, safety, and efficiency across operations.

